Este cáncer es el segundo en frecuencia que afecta las zonas expuestas al sol
en personas ancianas, después del carcinoma basocelular. Menos del 5%
metastatiza a los ganglios linfáticos regionales, las lesiones por lo general
infiltran en profundidad afectando la hipodermis.
Morfología
El carcinoma in situ, que no atraviesa la membrana basal de la unión dermoepidérmica, forma placas escamosas bien delimitadas. Las lesiones invasivas son nodulares con producción de queratina, apreciándose una escama hiperqueratósica que puede ulcerarse.
El carcinoma espinocelular in situ, afecta a todos los estratos de la epidermis (gran diferencia con las queratosis actínicas), posee células con núcleos atípicos (hipercromáticos y aumentados de tamaño). El carcinoma infiltrante tiene distintos grados de diferenciación, desde células poligonales con amplias zonas de extensión hasta células anaplásicas con queratinización de célula individual abortiva (disqueratosis: queratinización anormal prematura en las células por debajo del estrato córneo).
El querantoacantoma es considerado por algunos como una variante del carcinoma espinocelular bien diferenciado, pero también como entidad diferente. Se caracteriza por un período de crecimiento rápido tras el cual regresa espontáneamente, formado por lóbulos de células escamosas con un citoplasma que sufre queratinización sin una capa granulosa interpuesta.
Morfología
El carcinoma in situ, que no atraviesa la membrana basal de la unión dermoepidérmica, forma placas escamosas bien delimitadas. Las lesiones invasivas son nodulares con producción de queratina, apreciándose una escama hiperqueratósica que puede ulcerarse.
El carcinoma espinocelular in situ, afecta a todos los estratos de la epidermis (gran diferencia con las queratosis actínicas), posee células con núcleos atípicos (hipercromáticos y aumentados de tamaño). El carcinoma infiltrante tiene distintos grados de diferenciación, desde células poligonales con amplias zonas de extensión hasta células anaplásicas con queratinización de célula individual abortiva (disqueratosis: queratinización anormal prematura en las células por debajo del estrato córneo).
El querantoacantoma es considerado por algunos como una variante del carcinoma espinocelular bien diferenciado, pero también como entidad diferente. Se caracteriza por un período de crecimiento rápido tras el cual regresa espontáneamente, formado por lóbulos de células escamosas con un citoplasma que sufre queratinización sin una capa granulosa interpuesta.
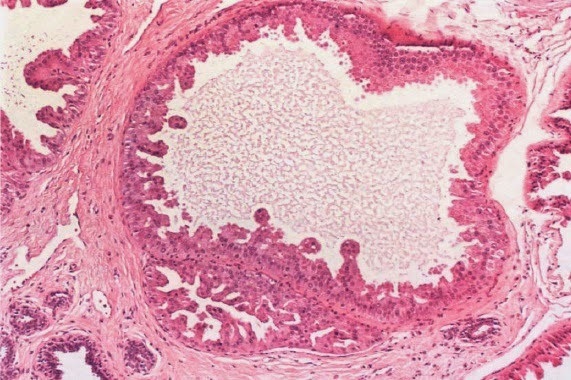
Vista macro y miscroscópica de un querantoacantoma. Las mutaciones presentes de p53 sugiere ser una variante del carcinoma espinocelular, suele regresar espontáneamente a los meses, es más frecuente en zonas expuestas al sol en hombres mayores de 50 años. Macroscópicamente es una lesión nodular con un cráter central lleno de queratina. En la vista microscópica se observa una lesión endofítica con un tapón central de queratina con un espitelio escamoso bien diferenciado extendiendose hacia la dermis, las células son grandes con citoplasma hialino y escasa atipía.
Vista macroscópica de un carcinoma espinocelular en una zona expuesta al sol y a otros carcinógenos.
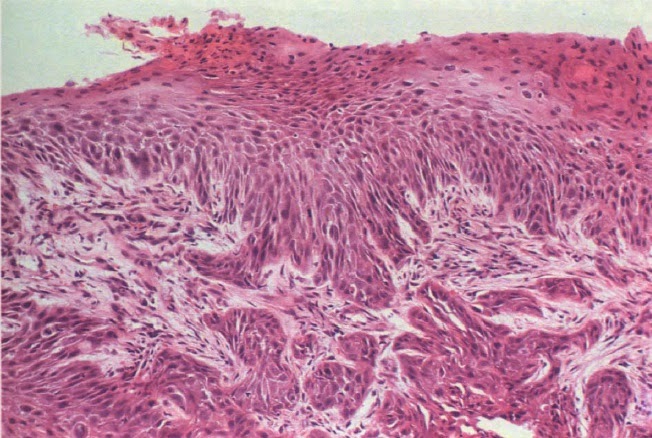
Vista microscópica de un carcinoma espinocelular. En esta imagen el cáncer no atraviesa la membrana basal por lo que es un carcinoma in situ, a la derecha se observa piel normal, a la izquierda se observan las células con pleomorfismo e hipercromasia.
Vista microscópica de un carcinoma espinocelular infiltrante, se observa la extensión de lengüetas epidermicas invadiendo la dermis.
Patogenia
La causa
mas importante es la exposición a la luz UV la cual produce daño a nivel del
ADN, la incidencia es proporcional al grado de exposición solar. Un segundo factor es la inmunodepresión, la
cual contribuye al disminuir la respuesta del anfitrión y aumentar la
vulnerabilidad de los queratinocitos a la infección y transformación por virus
oncogénicos, como VPH subtipos 5 y 8. Otros factores asociados pueden ser
carcinógenos industriales (alquitranes y aceites), úlceras crónicas y
osteomelitis, cicatrices de quemaduras antiguas, radiación ionizante y el
tabaquismo.
La incidencia de mutaciones del gen supresor de tumores p53 en personas de raza blanca con queratosis actínicas es elevada, indicando la relación entre ésta mutación y la exposición solar. Si p53 no es funcional al estar mutado su gente, al haber daño de ADN por rayos UV, las cinasas encargadas de enviar estas señales a p53 no pueden lograr detener la célula para reparar los daños, lo cual acumula mutaciones y son transferidas a células hijas.
En la xerodermia pigmentaria, la propensión al carcinoma espinocelular también es alta (2000 veces mayor el riesgo de padecerlo), en éste trastorno, se encuentra alterada la vía de reparación de los dímeros de pirimidina, ocurriendo lo mismo que en las mutaciones de p53, acumulación de las mutaciones.
La incidencia de mutaciones del gen supresor de tumores p53 en personas de raza blanca con queratosis actínicas es elevada, indicando la relación entre ésta mutación y la exposición solar. Si p53 no es funcional al estar mutado su gente, al haber daño de ADN por rayos UV, las cinasas encargadas de enviar estas señales a p53 no pueden lograr detener la célula para reparar los daños, lo cual acumula mutaciones y son transferidas a células hijas.
En la xerodermia pigmentaria, la propensión al carcinoma espinocelular también es alta (2000 veces mayor el riesgo de padecerlo), en éste trastorno, se encuentra alterada la vía de reparación de los dímeros de pirimidina, ocurriendo lo mismo que en las mutaciones de p53, acumulación de las mutaciones.
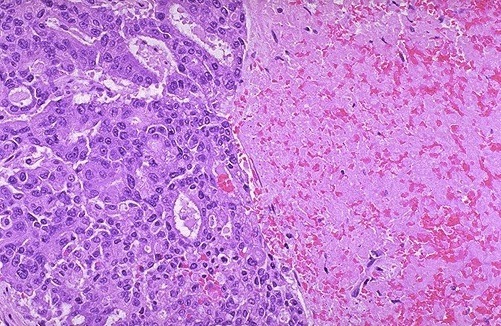
Vista microscópica de un carcinoma espinocelular retroauricular.

Otra vista macroscópica de un carcinoma espinocelular en un paciente con xerodermia pigmentaria, en donde el riesgo de padecer éste cáncer es elevado.
Pronóstico y tratamiento
En
el caso del carcinoma espinocelular rige
el principio de que cuanto antes se detecta y trata el tumor, mejores son las
perspectivas de curación. Por lo general los carcinomas espinocelulares de pequeño tamaño aún no se han
diseminado. En dichos casos se trata de eliminar el tumor por completo
de la piel. Si hay afectación de los ganglios linfáticos adyacentes,
también se practica su resección. Además de estas intervenciones, en algunas ocasiones
se aplica radioterapia o quimioterapia. Los controles de seguimiento estrictos son importantes
para poder detectar con anticipación suficiente una posible reaparición del
tumor tras concluir el tratamiento (recidiva).