Consiste en la metaplasia intestinal dentro de la mucosa escamosa del epitelio esofágico: el epitelio esofágico cambia de estratificado plano a uno columnar con células caliciformes.
Vista macroscópica de la mucosa esofágica normal, de color pálido, con la unión gastroesofágica en el medio y la mucosa gástrica a la derecha.
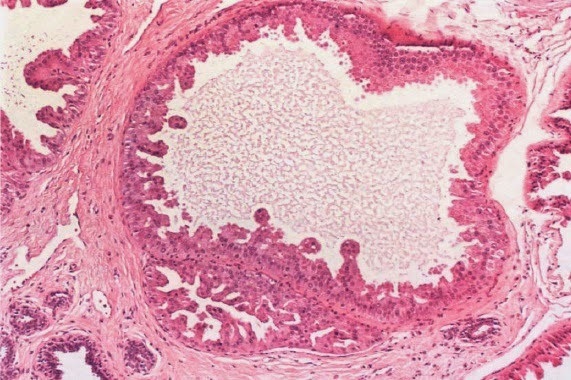
Vista microscópica de un esófago normal, se observa a la izquierda la mucosa escamosa, por debajo de ella la submucosa conteniendo glándulas mucosas, un folículo linfoide y a la derecha la capa muscular.
Epidemiología
Se da en el 10% de los sujetos con ERGE sintomático. Es mas frecuente en raza blanca y en varones, entre los 40 y 60 años de edad. Esta patología se encuentra ampliamente relacionada al adenocarcinoma de esófago, por lo que alguno autores optan por llamarla un proceso premaligno. La displasia se encuentra en el 0,2 al 2% de las personas con esófago de Barrett cada año.
Algo importante a tener en cuenta es que la mayoría de los adenocarcinomas de esófago se asocian a pacientes con esófago de Barret, la mayoría de las personas con esta patología no desarrollan tumores esofágicos.
Vista macroscópica de un esófago de Barrett, se observan islas de metaplasia intestinal rojiza en el esófago inferior, rodeadas de mucosa sana color pálido, la ulceración produce hemorragia y dolor.
Vista microscópica de esófago de Barrett. Se observa a la derecha epitelio escamoso normal, y a la izquierda epitelio cilíndrico anormal, con células caliciformes.
La mucosa afectada es roja aterciopelada, que se extiende desde la unión gastroesofágica hacia arriba, esta mucosa hiperplásica se alterna con mucosa escamosa residual pálida y homogénea (esofágica).
Se los puede subdividir en: de segmento corto (cuando se afecta menos de 3 cm de la mucosa) o de segmento largo (mas de 3 cm).
La presencia de displasia se clasifica de alto o de bajo grado, ambos grados consisten en un aumento de la proliferación epitelial, con mitosis atípicas, hipercromasia, aumento de la relación núcleo/citoplasma y fracaso de la maduración de las células epiteliales cuando migran hacia la superficie. Las glándulas son anormales, con gemaciones, formas irregulares y superpoblación celular.
Esófago de Barret, vista microscópica, con displasia de bajo grado. Se observa proliferación epitelial, con mitosis atípicas, hipercromasia, aumento de la relación núcleo/citoplasma.

Vista microscópica de esófago de Barrett con displasia de alto grado, con riesgo aumentado de progresión a adenocarcinoma de esófago. Las células presentan nucleólos grandes, hipercromasia, aumento de la actividad mitótica, las glándulas estan todas juntas y presenta forma irregular.
Vista microscópica, a mayor aumento, de esófago de Barrett con displasia. Hay estratificación de las células epiteliales glandulares con una pérdida de la polaridad.
Diagnóstico
Se realiza en primer instancia una endoscopía a los pacientes con síntomas de ERGE, y luego el diagnóstico definitivo se realiza con una biosia en la cual el elemento definitivo para el diagnóstico es la presencia de células caliciformes,
En la endoscopía se percibe una mucosa anormal por encima de la unión gastroesofágica y metaplasia intestinal demostrada. Las células caliciformes contienen vacuolas mucosas que se tiñen de azul en la tinción con H y E, con su forma característica de caliz, confirmando la metaplasia intestinal.
Endoscopía de esófago inferior que pone en evidencia zonas de metaplasia intestinal rojizas por encima de la unión gastroesofágica, si la zona afecta es menor a 3 cm de llama esófago de Barret de segmento corto.
Clínica
El paciente presenta disfagia, hematemesis, pirosis, acidez, regurgitaciones, dolor retroesternal y disminución significativa del peso.